关于仿制药质量和疗效一致性评价的 参比制剂采购通知书
我们的服务为响应国家实施一致性评价政策,现扩展参比制剂一次性进口服务业务,拥有欧洲、日本多国合法、合规供应商,能为您提供药品一致性评价所需的参比制剂以及相关技术支持,并已有多项成功案例,欢迎广大新老客户在线或来电咨询!
H5,H5页面制作工具


- 参比制剂采购通知书
- 关于仿制药质量和疗效一致性评价的



- 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。否则存在较大风险失去市场甚至文号不保。

- 1
- 2
- 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
- 背景信息







- 总局关于研制过程中所需研究用对照药品一次性进口有关事宜的公告




- 重视药学研究仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。

- 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。



- 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企 业的时间已经非常紧张,即使一切顺利也需要20-25个月。
- 逐步开展,分段进行仿制药一致性评价是一个综合工程,链条长,费用高。尤其是早年完成注册的产品,注 册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
- 不等不靠、主动研究。

- 虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。我们基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:
- 我们的认识与建议





- 经过不懈的努力,我们为国内医药企业提供以下原产地原研药产品的购买服务,并可根据厂家需求,在国家食品药品监督管理局下发的仿制药一致性评价目录中的289种药品,进行国外原研药产品的购买。

- 服务的产品

- 为响应国家实施一致性评价政策,现扩展参比制剂一次性进口服务业务,拥有欧洲、日本多国合法、合规供应商,能为您提供药品一致性评价所需的参比制剂以及相关技术支持,并已有多项成功案例,欢迎广大新老客户在线或来电咨询!
- 我们的服务



- 英国盐酸乐卡地平片
- 日本药
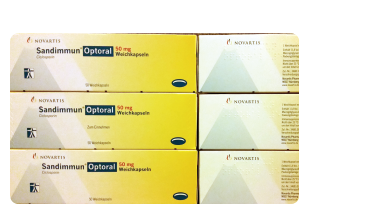
- 德国环孢素胶囊
- 法国奥硝唑片500毫克
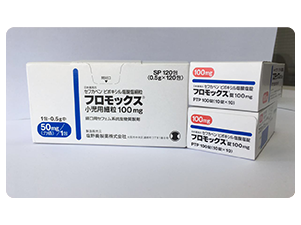
- 日本药
- 日本药



- 药物照片

- 意大利克拉霉素250毫克


- 日本药



- 德国双氯芬酸钠片25毫克

- 英国阿奇霉素
- 服务产品


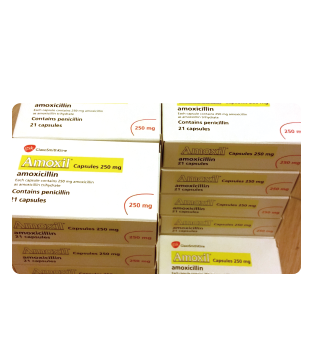
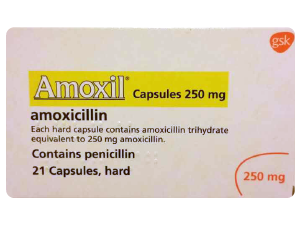
- 英国阿莫西林250毫克-1
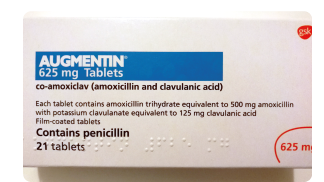
- 英国阿莫西林克拉维酸钾片


- 英国阿莫西林250毫克-2









- 原研药采购流程

- 参比制剂采购
- 一次性进口入关
- 通过境内、境外合作伙伴以合法、合规的专业渠道获得不同批号,一至三批参比制剂,确认后签订合同
- 通过专业、合规的进出口渠道,协助入关,代缴关税、增值税,获取相关证明文件,协助企业通过口岸药检所的检验
- 4
- 一次性进口批件申请

- 协助企业填写一次性进口批件,筛选最合适的包装规格
- 2
- 3

- 1
- 协助企业查找项目参比制剂,并进行参比制剂备案工作

- 参比制剂的选择及备案







- 刘女士 13810869582
- 张先生 13910168535
- 联系人